|
Abstract STRESS AND SOME PROBLEMS OF ADAPTABLE REORGANIZATIONS AT SPORTS LOADS A.S. Rozenfeld, Dr. Biol. professor E.I. Maevsky, The doctor of medical sciences professor The Russian state professional-pedagogical university, Ekaterinburg Institute of theoretical and experimental biophysics of the Russian Academy of Science. Puschino Key words: stress, adaptation, physical load, mitochondrions, succinate, antioxidizer, peroxidation, acidosis. The stress can result in the derangements of the balance of physiological systems and the constancy of internal environment. It is necessary to support the constancy of physical and chemical parameters of an organism for the counteraction of the destructive influences of stress. The experiments executed at the level of the complete organism and tissue for the first time HAD showed the opportunity of maintenance of the acid-base balance at loads due to increase of the contribution of mitochondrions in synthesis of adenosinetriphosphate by use of exogenous mitochondrion substrata. The oxidation of exogenous succinate in an organism up to СО2 repeatedly grows at loads. The range of reactance of the acid-base balance of blood is increased as well as at growth of sports skill after intake of succinate: the acidosis decreases at standard on capacity physical loads and grows the ability to withstand the deep acidosis at maximum loads. The exogenous succinate in an organism renders direct substratum and mediated influence, including hormonal system.
|

СТРЕСС И НЕКОТОРЫЕ ПРОБЛЕМЫ АДАПТАЦИОННЫХ ПЕРЕСТРОЕК ПРИ СПОРТИВНЫХ НАГРУЗКАХ
Доктор биологических
наук, профессор А.С. Розенфельд Российский
государственный
профессионально-педагогический
университет, Екатеринбург
Стресс-реакция - особое состояние организма, возникающее в ответ на сильный внешний раздражитель физического, химического, биологического или психического характера. Эта реакция проявляется в неспецифическом ответе организма на воздействие и называется общим адаптационным синдромом (ОАС) [12]. В своем течении она имеет три стадии. Первая - тревоги, вторая - резистентности и третья - истощения . Основные механизмы развития стресса согласно теории Г. Селье гормональные [12, 24]. Стресс может привести к нарушению баланса физиологических систем организма и постоянства его внутренней среды [4]. В организме человека существует по крайней мере две функциональные системы, созданные эволюцией для противодействия его разрушительной силе. Это симпато-адреналовая система, открытая В. Кенноном, и гипоталамо -надпочечниковая, открытая Г. Селье. Особое значение стресс приобретает в формировании адаптивных и приспособительных процессов при физических и психоэмоциональных нагрузках. Как показали Г. Селье [12, 13], Л.Х. Гаркави и др. [1], стресс-стимулы помимо деструктивных воздействий могут вызывать и благотворные изменения в организме, активизируя его защитные силы и способствуя адекватным функциональным перестройкам. Одну из главных и нерешенных проблем при этом можно сформулировать следующим образом: стресс - это хорошо или плохо? На этот вопрос не смог ответить даже сам Г.Селье. Впоследствии он был вынужден выдвинуть понятие "хорошего" и "плохого" стресса (эустресс и дистресс), чем в значительной степени разрушил целостность своей концепции [13]. Действительно, где тот "гомункулус", который отделяет "хорошие" стрессоры от "плохих"? В бытующем представлении о стрессе организм представлен пассивным объектом приложения его воздействий. Между тем человек в ответ на действие стрессора осуществляет различные поведенческие реакции. Зачастую характер реагирования не в меньшей степени, чем сила или длительность воздействия, определяет общую резистентность организма. Нередко длительная и напряженная борьба человека за желанную цель, с присущими ей неудачами, не только не приводит к истощению, а, наоборот, способствует сохранению психического и телесного здоровья [15]. В то же время существуют так называемые болезни достижения, или "синдром Мартина Идена". Экспериментальные и клинические наблюдения показывают, что лучше испытывать неприятные переживания, стимулирующие к поиску выхода из затруднительного положения, чем находиться в расслабленном состоянии пассивного удовлетворения собой и миром ("синдром Обломова"). Следовательно, характер реагирования на стресс-стимулы обусловлен не только функциональными реакциями, но в значительной степени и воспитанием человека, которое проявляется в его поведении, а следовательно, служит отражением его психических характеристик, которые определяются высшими отделами центральной нервной системы. Г.Н. Кассиль [3] подчеркивает, что регуляция системы ""гипоталамус - гипофиз - кора надпочечников" осуществляется в цепи нейронов, имеющих различную медиаторную природу (адренэргическую, холинэргическую и серотонинэргическую). По его мнению, при длительных стресс-воздействиях стадия истощения формируется следующим образом: кортикостероиды, циркулирующие в кровяном русле, связываются с особым белком крови - транскортином. Это соединение не проникает в структуры головного мозга, так как задерживается гематоэнцефалическим барьером [3]. В результате в мозг не поступает информация о содержании кортикостероидов в крови, что приводит к нарушению обратной связи и расстройству регуляции функций, поскольку непрерывное поступление в кровь кортикостероидов сопровождается истощением коры надпочечников, а впоследствии и его мозгового слоя. Таким образом, возникновение фазы истощения при стрессе следует рассматривать как следствие нарушения механизма саморегуляции гормонов, что приводит к деструктивным процессам в организме. Большинство из этих постулатов свойственно и физической нагрузке, особенно в период соревновательной деятельности, когда выброс катехоламинов и кортикостероидов возрастает, многократно увеличивается концентрация молочной кислоты, снижается рН крови, что вызывает нарушение баланса буферных систем и постоянства внутренней среды организма. Все это, по мнению В. Кеннона [4], указывает на наличие стресса. Вне сомнений, избыточное накопление лактата, сдвиг рН в кислую сторону (ацидоз) сопряжены с развитием нагрузочной гипоксии. Все это приводит к активации перекисного окисления, а соответственно и запуску механизмов наработки свободных радикалов, которые вызывают деструктивные изменения молекул белков ДНК, биологических мембран и других внеклеточных и внутриклеточных структур. Так степень повреждения митохондриальных структур ключевым образом сказывается на судьбе каждой клетки: будет ли она восстанавливаться, пойдет ли по пути программируемой гибели - апоптоза или будет подвергнута некрозу [22, 23]. Исследования последних лет выявили определяющую роль митохондрий (МХ) в реализации механизмов апоптоза и некроза дополнительно к известной их роли в обеспечении клетки энергией АТФ [14, 26]. Участие МХ в процессах апоптоза и некроза может быть охарактеризовано следующим образом. Согласно A.P. Haltstrap et al. [22], в клетке под воздействием различных повреждающих факторов происходит повышение концентрации ионов кальция (в интактной клетке концентрация Са2+=10-7/10-8 М), которые вызывают конформационные изменения адениннуклеотидтранслоказы (АНТ), расположенной во внутренней мембране МХ, и связывание АНТ с циклофилином Д (белком матрикса МХ). Такой ансамбль белков формирует и открывает неспецифическую, временно существующую специфически проницаемую пару (MPTP). Открытие MPTP вызывает набухание МХ и сброс трансмембранного потенциала, разобщение окислительного фосфорилирования и как следствие - деэнергизацию. В результате восстановить повреждения невозможно - развивается некроз. В условиях гипоксии и последующей реперфузии степень поражения клеток зависит от времени открытия и возможности закрытия МРТР. Различные агенты, способные предотвращать, укорачивать время открытия МРТР или закрывать неспецифическую пару, существенным образом уменьшают повреждения. В.П. Скулачев [25] полагает, что
апоптоз и митоптоз выполняют
функционально и эволюционно важную
роль в защите ткани от поврежденных
клеток и митохондрий. Мы считаем,
что это чрезвычайно важно в
появлении новых популяций клеток,
необходимых при становлении
адаптивных На основании вышесказанного можно заключить, что от силы и длительности стрессорного воздействия, которое оказывает физическая нагрузка, будет зависеть ответная реакция нейроэндокринной системы. И как следствие в результате изменения гормонального фона соответствующим образом будут реагировать и клеточные рецепторы, от которых зависит передача сигнала на внутриклеточные структуры. При этом будет меняться пул внутриклеточных гормонов и метаболитов с соответствующим переключением энергетики с аэробного на анаэробный и смешанный режимы работы. От последних составляющих будет зависеть концентрация свободнорадикальных форм в организме и степень стрессорного поражения, что определит путь дальнейшего развития клетки: пойдет ли она по пути фрагментарной адаптационной перестройки, по пути апоптической адаптации или станет на путь катаболического распада и некротической смерти. Соответственно при разработке методов и приемов, повышающих устойчивость и адаптацию организма к экстремальным состояниям, ключевым становится анализ механизмов развития и купирования метаболического ацидоза, который является определяющим фактором в активации перекисного окисления [10]. Последнее, как сказано выше, может приводить к аутохимическому травматизму тканевых структур. Для того чтобы избежать грубых деструктивных изменений, необходимо активизировать систему метаболической коррекции ацидоза, что в условиях соревновательной деятельности выполнить крайне сложно. Попытки, направленные на изменение интенсивности метаболических путей посредством гормонального воздействия, использования специальных диет, а также применени я нейростимуляторов, оказались губительными для здоровья и не обеспечили стабильно воспроизводимых высоких спортивных результатов. Возникает вопрос: можно ли в принципе уменьшить глубину или повысить переносимость метаболического ацидоза без снижения, а лучше даже при повышении мощности выполняемой нагрузки? Теоретический анализ и ранее полученные нами результаты позволили выдвинуть гипотезу о том, что для целенаправленных адаптивных перестроек и поддержания рН при возрастающих нагрузках необходимо изыскать возможность для активации митохондриальной системы энергообеспечения [8, 9, 11]. Причем это нужно сделать таким образом, чтобы наработка радикалов О2, которая на 70% происходит в митохондриях, была минимальна, а энергетический выход в виде ресинтеза АТФ - максимален. Согласно работам М.Н. Кондрашовой [6, 7] и L. Schild [26] такая ситуация возможна, если при фосфорилирующем дыхании митохондрий будет использоваться флавинзависимый субстрат сукцинат [10]. Более того, именно сукцинат способен активно окисляться в тканях при недостатке О2, при этом совместно с пируватом они являются хорошими антиоксидантами [20, 21].
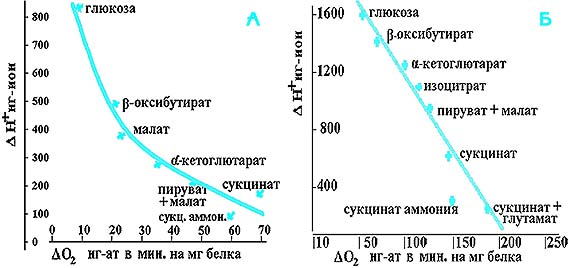
Рис. 1. Соотношение величин уборки ионов водорода при АТФ-азной нагрузке (гексокиназно-глюкозная система) и скорости фосфорилирующего дыхания при окислении различных субстратов МХ печени (А) и МХ сердца (Б) крысы. Инкубационная среда: 250 мМ сахароза (для МХ печени) или 125 мМ KCl (для МХ сердца), 1 мМ KH2PO4, (рН 7,0), 1мМ MgSO4, 0,5 мМ ЭГТА, 3 мМ АТР. Добавки субстратов по 5 мМ, гексокиназы 0,1 ед. Концентрация МХ печени - 3 мг белка на мл (t=26° C), МХ сердца - 1,2 мг белка на мл (t=29° C) В модельных экспериментах на изолированных митохондриях (рис.1, А, Б), при фиксированной АТФ-азной нагрузке нами было показано, что сдвиг рН внемитохондриальной среды тем меньше, чем выше скорость фосфорилирующего дыхания. Независимо от того, что использовалось при моделировании эксперимента - МХ печени или сердца, - наиболее эффективным субстратом оказывается сукцинат. Причем в случаях, когда появляется щавелевоуксусное торможение сукцинатдегидрогеназы, внесение в среду глутамата (см. рис. 1, Б) существенно повышает как скорость дыхания, так и захват ионов водорода из среды. Еще более эффективным оказалось использование сукцината аммония: при меньшей скорости дыхания обеспечивается большее ощелачивание. С помощью малых концентраций NEM - N-этилмалеимида, ингибитора переносчика фосфата, нам удалось показать, что уборка ионов водорода при окислительном фосфорилировании может быть полностью заторможена практически без изменения скорости дыхания (рис. 2). Полученные данные позволяют считать, что за уборку ионов водорода из цитозоля при энергообеспечении АТФ-азных нагрузок ответствен транспорт фосфата, который идет из внемитохондриальной среды в матрикс в симпорте c протоном. Таким образом, нам удалось экспериментально показать, что в условиях АТФ-азной нагрузки увеличение вклада МХ в энергообеспечение действительно способствует поддержанию рН. И дело здесь не в уменьшении концентрации лактата. Более того, использование лактата в качестве косубстрата может уменьшить развитие ацидоза, как это было показано нами в исследовании, выполненном совместно с Н. Ким [5] на гомогенате сердца крысы (рис. 3). Видно, что окисление лактата, особенно в паре с сукцинатом, способствует как уменьшению кислотного сдвига, так и поддержанию пула АТФ, очевидно, за счет увеличения вклада МХ в энергообеспечение (кривая 4). На основании представленных экспериментальных данных мы пришли к заключению, что в отличие от ранее используемых способов купирования метаболического ацидоза, развивающегося при физических нагрузках, необходимо увеличивать вклад митохондрий в энергообеспечение путем использования экзогенных субстратов, которые могут окисляться непосредственно в митохондриях, минуя реакции субстратного фосфорилирования в гликолитической оксидоредукции. В решении проблемы выбора экзогенного субстрата для поддержания функций МХ мы руководствовались метаболическими и технологическими критериями. Метаболические критерии включали три условия. Первое - субстрат должен быть энергетически высокоэффективным. Второе - он должен окисляться, несмотря на гипоксические условия, которые являются непременным атрибутом физической нагрузки субмаксимальной мощности. Третье - он должен проникать и окисляться митохондриями в условиях целостного организма. Технологические условия - доступность, дешевизна и стабильность субстрата.
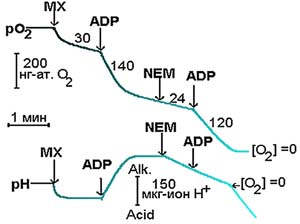
Рис. 2. Влияние ингибитора переносчика фосфата - NEM на скорость дыхания и связывание ионов водорода митохондриями печени крысы при фосфорилировании AДФ (скорость дыхания обозначалась нг-ат. О2 в мин на мг белка) По всем перечисленным параметрам, кроме третьего пункта, удовлетворить эти требования может субстрат цикла Кребса - сукцинат. Однако среди физиологов и биохимиков по поводу проницаемости данного метаболита существует твердая уверенность, что через неповрежденную мембрану эта кислота не проникает. Для выяснения этого вопроса мы вводили в желудок крыс через зонд меченый сукцинат в положении 2-3 по радиоактивному углероду 14С, при этом измеряли содержание 14С в выдыхаемой углекислоте через 10, 20 и 30 мин в покое и после плавания. Затем животных забивали и определяли содержание радиоактивной метки в крови и различных органах (табл.1). Как показано в табл. 1, даже в состоянии покоя в выдыхаемом воздухе обнаруживается значительное содержание меченного по 14С СО2 - до 16% от уровня суммарной радиоактивности введенного сукцината. При нагрузке включение метки из сукцината в СО2 возрастало почти в 6 раз. Ранее подобное ускорение метаболизма экзогенного субстрата было описано лишь для глюкозы [18, 19]. На фоне многократного ускорения окисления сукцината после физической нагрузки содержание метки в плазме крови и тканях снижалось в среднем в 2 раза по сравнению с уровнем, наблюдаемым в покое. Полученные данные свидетельствуют о том, что сукцинат, введенный в желудок животным, может проникать в кровь и в ткани и включаться в окислительно-восстановительные процессы, а также о том, что интенсивность окисления сукцината многократно возрастает при мышечной работе. При исследовании судьбы сукцината, меченного нерадиоактивным - стабильным изотопом 13С в положении 2-3, мы обнаружили (рис. 4), что после приема добровольцами 20 мг обогащенного стабильным изотопом 13С сукцината аммония метка выводится намного быстрее, чем после приема 20 мг глюкозы. Отсюда можно сделать заключение, что экзогенный сукцинат у человека используется в окислительно-восстановительных процессах быстрее, чем экзогенная глюкоза. Итак, нами показано, что в условиях целостного организма экзогенный сукцинат может быстро окисляться и скорость его окисления зависит от интенсивности нагрузки. Далее возник вопрос: можно ли с помощью экзогенного сукцината повлиять на глубину метаболического ацидоза при интенсивной мышечной работе? Интенсивная мышечная работа моделировалась с помощью велоэргонометрической нагрузки (ВЭ) субмаксимальной мощности. Добровольцы за 20-25 мин до работы выпивали 10%-ный водный раствор сукцината из расчета 10 мг на кг массы тела.
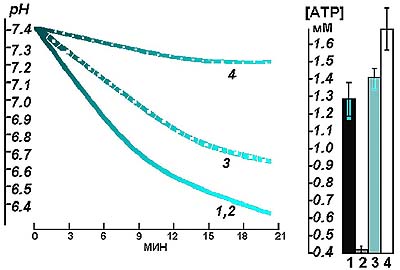
Рис. 3. Влияние окисления различных субстратов на величину рН и концентрацию АТФ в гомогенате сердца крысы. (Инкубационная среда, как на рис.1. Добавки субстратов: 1 - глюкоза 5 мМ; 2 - глюкоза 5 мМ + лактат 10 мМ; 3 - глюкоза 5 мМ + сукцинат 5 мМ; 4 -сукцинат 5 мМ + лактат 5 мМ.) Однократный прием сукцината перед стандартной, субмаксимальной по мощности ВЭ нагрузкой (300 Вт, 3 мин) способствовал уменьшению глубины посленагрузочного ацидоза. При этом нагрузка субъективно переносилась намного легче. Субъективное улучшение переносимости нагрузки сочеталось со снижением уровня нагрузочной тахикардии. Так, ЧСС без предварительного приема сукцината достигала 186±7,4 уд/мин, а на фоне сукцината - 164±4,1 уд/мин (р < 0,02). Таким образом, мы обнаружили, что использование сукцината в качестве пищевой добавки способствует уменьшению метаболического ацидоза при выполнении стандартных, субмаксимальных по мощности, нагрузок. Это можно расценивать как увеличение вклада митохондриальной системы в энергообеспечение мышечной работы. Далее исследовалось влияние не только однократного, но и длительного (табл. 2) приема (ежедневно в течение 10 дней) сукцината на способность спортсменов выполнять предельную ступенчатую ВЭ нагрузку до отказа. Таблица 1. Содержание 14С в выдыхаемом воздухе и в тканях крыс после введения животным в желудок меченого 2.3. - 14С-сукцината
* Во всех случаях при сравнении данных 2-й и 1-й групп различия статистически значимы при р< 0,01.
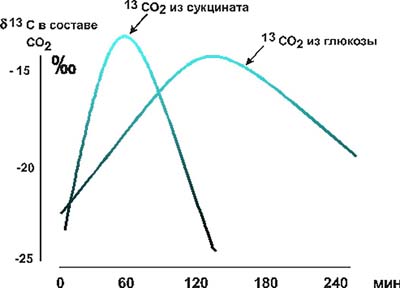
Рис. 4. Динамика выведения 13СО2 с выдыхаемым воздухом после приема добровольцем 20 мг глюкозы или 20 мг сукцината, обогащенных стабильным изотопом 13С. (Изотопный анализ состава углекислоты производился масспектрометрическим методом.) Было обнаружено, что использование сукцината непосредственно перед предельной нагрузкой способствовало существенному приросту работоспособности: объем выполняемой работы повышался в среднем на треть, при этом содержание лактата, пирувата, отношение лактат/пируват, кислотный сдвиг рН и буферных оснований оставался на таком же уровне, что и до приема сукцината. После 10 дней тренировочного процесса (без приема сукцината) объем выполняемой работы при предельной ступенчатой ВЭ нагрузке возрастал в среднем на 9% (р> 0,05, табл. 2), тогда как после 10 дней приема сукцината во время того же тренировочного цикла объем выполняемой работы вырастал на 34%. Таким образом, по сравнению с контрольной группой десятидневный прием сукцината способствовал дополнительному приросту работоспособности на 25%, но при этом развивался более глубокий ацидоз, регистрируемый практически во всех измеряемых параметрах. Следовательно, прием сукцината в ходе тренировочного цикла способствовал увеличению диапазона реактивности кислотно-основного состава (КОС) крови. Полученные данные свидетельствуют о достаточно высокой эффективности однократного и многократного приема сукцината. Безусловно, на уровне организма наблюдаемые эффекты сукцината нельзя рассматривать только с позиции его участия в цикле трикарбоновых кислот. Возникло предположение, что сукцинат, оказавшись вне МХ, вне клеток, в крови может выполнять регуляторную функцию, сигнализируя о появлении кислородного дефицита, поскольку в процессе эволюции является конечным продуктом анаэробного обмена в МХ [16, 17]. Попадание молекулы эндогенного сукцината в кровоток из клеток или экзогенного сукцината из желудочно-кишечного тракта воспроизводит естественный информационный сигнал. В связи с этим мы провели у добровольцев исследования влияния приема сукцината на экскрецию катехоламинов. Оказалось, что как малые (2 мг сукцината на 1 кг массы тела), так и большие (20 мг на 1 кг) дозы могут изменять величину диуреза и объем экскреции катехоламинов с мочой (табл. 3). Как показано в табл. 3, не только величина, но и направленность действия высоких доз сукцината существенно зависели от исходного состояния обследуемых субъектов. Не исключено, что на уровне целостного организма влияние сукцината приводит к нормализации как диуреза, так и экскреции катехоламинов. Учитывая "анаэробное прошлое" сукцината и его способность увеличивать вклад аэробных процессов в энергообеспечение мышечной работы, мы исследовали его влияние на диссоциацию оксигемоглобина in vitro и на периферический кровоток в условиях целостного организма. Оказалось, что сукцинат так же, как и другие органические кислоты, влияет на кривую диссоциации оксигемоглобина, сдвигая ее вправо (рис. 5), то есть улучшает отдачу кислорода. И хотя этот эффект наблюдался нами при достаточно высоких концентраци ях сукцината (1 мМ), следует отметить, что эта концентрация в 30 раз меньше, чем концентрация лактата, вызывающая подобный сдвиг кривой диссоциации оксигемоглобина [2]. В условиях целостного организма при регистрации оксигемограммы обнаружена более высокая степень оксигенации гемоглобина в смешанной капиллярной крови через 15 мин после приема сукцината. Возможно, это связано с изменением регионального кровотока. Реографические исследования (выполненные совместно с Н.К. Быстровой) показали, что через 5 -10 мин после приема сукцината наблюдается улучшение венозного оттока. Субъективно отмечается преходящее ощущение притока крови к голове и конечностям, а также гиперемия кожи. Вероятно, что именно с лучшей перфузией мышц под влиянием сукцината и с более эффективным вымыванием недоокисленных продуктов из работающих мышц связано повышение работоспособности при высокоинтенсивных нагрузках и более выраженное снижение рН крови. Таблица 2. Реакция КОС крови спортсменов на предельную ступенчатую ВЭ нагрузку до и после 10 дней тренировок с ежедневным приемом сукцината
Таблица 3. Экскреция адреналина и норадреналина с мочой у людей после приема разных количеств сукцината
* 3-я и 4-я группа отличаются по величине и динамике диуреза: в 3-й группе исходно повышенный диурез снижался, а в 4-й группе исходно низкий диурез возрастал в 2 раза; pдо - сравнение с уровнем до введения сукцината.
Рис. 5. Сдвиг кривой диссоциации после инкубации цельной крови с 1 мМ сукцината Na в течение 20 мин (рН=7,4 при 37° С) На основании выполненного эксперимента можно заключить, что прием сукцината увеличивает работоспособность, поддерживает естественные компенсаторные реакции, направленные на расширение диапазона реактивности КОС крови: способствует уменьшению кислотного сдвига рН при стандартных умеренных и субмаксимальных нагрузках и обеспечивает поддержание работоспособности на фоне углубляющегося ацидоза при предельных нагрузках, подобно тому как это наблюдается при естественном росте тренированности. Составными частями эффектов экзогенного сукцината является окисление сукцината как субстрата энергетического обмена и опосредованное регуляторное воздействие, в частности на катехоламиновую систему, диссоциацию оксигемоглобина и периферический кровоток. Литература 1. Гаркави Л.Х., Квакина Е.Б., Уколова М.А. Роль адаптационных реакций в патологических процессах и простые критерии этих реакций / Регуляция энергетического обмена и устойчивость организма. Пущино, 1975, с. 172-181. 2. Гиммерих Ф.И. О регулировании отдачи кислорода эритроцитами. -- В кн.: Кислородный режим организма и его регулирование. Киев, 1966, с. 134-141. 3. Кассиль Г.Н. Внутренняя среда организма. - M.: Наука, 1983, с. 2. 4. Кеннон В. Физиология эмоций. Телесные изменения при боли, голоде, страхе и ярости. - Л.: Прибой, 1927.- 267 с. 5. Ким Н.П. Регуляция энергетического обмена в миокарде с помощью комбинации глюкозы, лактата и сукцината: Автореф. канд. дис. М., 1987.- 24 с. 6. Кондрашова М.Н. /В сб.: Регуляция энергетического обмена и устойчивость организма. Пущино, 1975, с. 3-21. 7. Кондрашова М.Н. Взаимодействие процессов переаминирования и окисления карбоновых кислот при разных функциональных состояниях ткани. Биохимия, т. 56, вып. 3, 1991, с. 388-405. 8. Кондрашова М.Н., Маевский Е.И. Взаимодействие гормональной и митохондриальной регуляции. - В кн. Регуляция энергетического обмена и физиологическое состояние организма.- М: Наука, 1978, с. 217-229. 9. Кондрашова М.Н., Чаговец Н.Р. Янтарная кислота в скелетных мышцах при интенсивной деятельности и в период отдыха. Докл. АН СССР, 1971, т. 1, с. 243-246. 10. Медведев Ю.В., Толстой А.Д. Гипоксия и свободные радикалы в развитии патологических состояний организма. - М.: ООО "Терра - Календер и Промоушн" . 2000. - 232 с. 11. Розенфельд А.С. Некоторые физиологические и фармакологические способы регуляции кислотно-основного состояния крови у спортсменов. Свердловск, 1980. - 42 с. 12. Селье Г. На уровне целого организма. М., 1972. - 258 с. 13. Селье Г. Стресс без дистресса. М., 1979. - 194 с. 14. Скулачев В.П. Рассказы о биоэнергетике. - М.: Молодая гвардия, 1982. - 243 с. 15. Фомин Н.А. Физиология человека. - М.: Владос, 1995. - 416 с. 16. Хочачка П., Сомерo Дж. Биохимическая адаптaция. - М.: Мир, 1988.- 568 с. 17. Хочачка П., Сомеро Дж. Стратегия биохимической адаптации. - М.: Мир, 1977. - 398 с. 18. Яковлев Н.Н. Биохимия движений. (Молекулярные основы мышечной деятельности.) Л. 1983. - 189 с. 19. Яковлев Н.Н. Биохимия спорта. М.,1974. - 286 с. 20. Di Lisa F., Menabo R., Canton M., Petronilli V. The role of mitochondria in the salvage and the injury of the ischemic myocardium. Biochim. Biophys. Acta. 1998. Aug. 10, 1366 (1-2), p. 69-78. 21. Fontaine E., Eriksson O., Ichas F., Bernardi P. Regulation of the permeability transition pore in skeletal muscle mitochondria. Modulation By electron flow through the respiratory chain complex i. J. Biol. Chem. 1998. May 15; 273(20):12662-8. 22. Halestrap A.P., Price N.T. The proton-linked monocarboxylate transporter (MCT) family: structure, function and regulation. Biochem. J. 1999. Oct.15, 343. Pt 2, p. 281-299. 23. Halestrap A.P., Woodfield K.Y., Connern C.P. Oxidative stress, thiol reagents, and membrane potential modulate the mitochondrial permeability transition by affecting nucleotide binding to the adenine nucleotide translocase. J. Biol. Chem. 1997. Feb. 7, 272 (6), p. 3346-3354. 24. Selye H. Stress in health and desease. Boston; London, 1976. 216 р. 25. Skulachev V.P. Cytochrome c in the apoptotic and antioxidant cascades. FEBS Lett. 1998 Feb 27;423(3):275-280. Review. 26. Schild L., Reinheckel T., Wiswedel I., Augustin W. Short-term impairment of energy production in isolated rat liver mitochondria by hypoxia/reoxygenation: involvement of oxidative protein modification. Biochem. J. 1997. Nov. 15; 328 ( Pt 1): 205-210.
При любом использовании данного материала ссылка на журнал обязательна! | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
 Ключевые слова: стресс,
адаптация, физическая нагрузка,
митохондрии, сукцинат,
антиоксидант, перекисное
окисление, ацидоз.
Ключевые слова: стресс,
адаптация, физическая нагрузка,
митохондрии, сукцинат,
антиоксидант, перекисное
окисление, ацидоз.